DDS|全球首款奧曲肽膠囊獲FDA批準上市!
2020-06-28 08:27:25
linda
1139
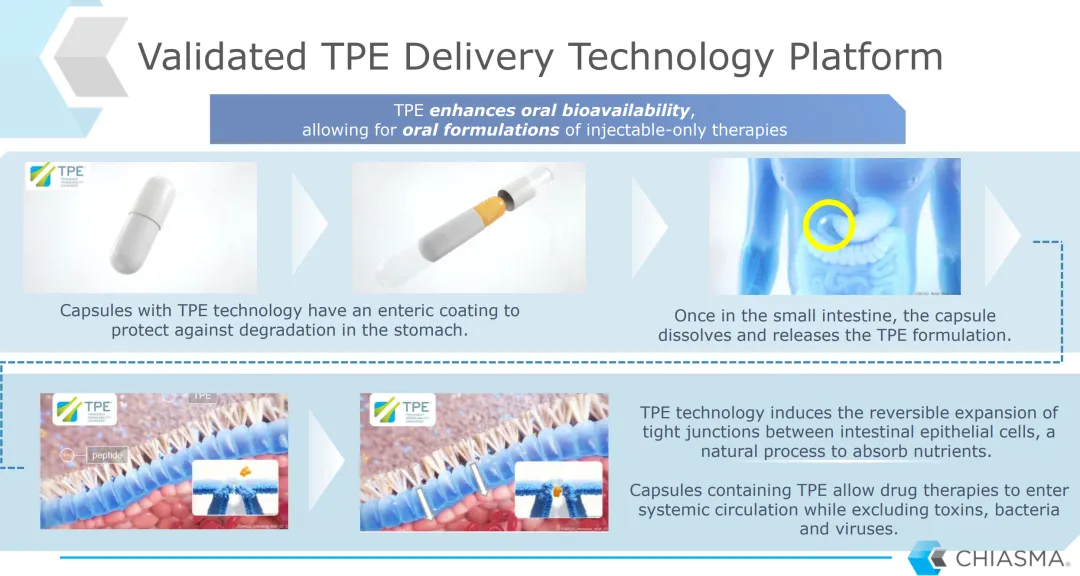
-MYCAPSSA適用于對奧曲肽或蘭瑞肽有反應(yīng)并耐受治療的肢端肥大癥患者的長期維持治療2020年6月26日��,Chiasma����,Inc.(納斯達克股票代碼:CHMA)宣布,美國食品藥品監(jiān)督管理局(FDA)批準了MYCAPSSA?(奧曲肽膠囊)用于對奧曲肽(octreotide)或蘭瑞肽(lanreotide)有反應(yīng)并耐受治療的肢端肥大癥患者的長期維持治療�。MYCAPSSA是FDA批準的第一個也是唯一的口服生長抑素類似物(SSA),也是FDA批準的第一個利用Chiasma的瞬時滲透性增強劑(TPE?)技術(shù)的產(chǎn)品���。肢端肥大癥是一種罕見的慢性疾病�����,通常由垂體良性腫瘤引起���,其特征是過量產(chǎn)生生長激素和胰島素樣生長因子-1激素,經(jīng)常通過長期繁重的注射治療�����。如果不加以治療�����,肢端肥大癥會導致嚴重的疾病���,有時甚至危及生命���。該公司估計,在美國�����,大約有8,000名患者正在接受可注射的生長抑素類似物(SSA)。

Chiasma首席執(zhí)行官Raj Kannan表示:“ FDA對MYCAPSSA的批準代表了肢端肥大癥患者的重大治療進展�����,并驗證了我們的TPE輸送平臺���?!?“我們感謝患者����,醫(yī)療保健提供者,倡導者和臨床試驗研究人員��,以及我們?yōu)閷YCAPSSA帶給肢端肥大癥患者而勤奮工作的員工�。隨著我們作為商業(yè)公司進入下一個激動人心的階段,我們準備通過與醫(yī)療保健提供商合作在美國成功實施�,將MYCAPSSA帶給可以從中受益的盡可能多的患者?����!?/span>
Acromegaly Community���,Inc.總裁Jill Sisco說:“患有肢端肥大癥的人面臨著與可注射療法相關(guān)的許多挑戰(zhàn)�����,需要新的治療選擇����。整個肢端肥大癥社區(qū)一直在等待口服治療選擇,這令人欣慰�。看到FDA現(xiàn)在已經(jīng)批準了第一種口服SSA治療�,它有可能對肢端肥大癥患者及其護理人員的生活產(chǎn)生重大影響�����?����!?/span>該公司希望MYCAPSSA能夠在2020年第四季度上市����,但要得到FDA及時批準已批準的NDA的計劃制造補充。Chiasma計劃擴大其面向客戶的團隊在銷售���,患者服務(wù)和市場準入方面的規(guī)模�����,大約有45名員工��。為了幫助患者改用MYCAPSSA��,Chiasma計劃提供一系列的患者支持服務(wù)�,范圍從保險提供商和專業(yè)藥房協(xié)助到為患者提供支持,以幫助將MYCAPSSA無縫整合到他們的日常生活中��。該公司認為���,患者���,醫(yī)生,護士和付款人將欣賞MYCAPSSA所帶來的巨大收益��。為了確?;颊吣軌驈V泛獲得這項創(chuàng)新,Chiasma計劃以美國肢端肥大癥市場增長最快的SSA來對MYCAPSSA進行有競爭力的定價����,以反映MYCAPSSA為醫(yī)療保健系統(tǒng)提供的價值。FDA批準MYCAPSSA是基于奧曲肽膠囊的隨機,雙盲��,安慰劑對照�����,為期9個月的3個月CHIASMA OPTIMAL臨床試驗的陽性結(jié)果����,該試驗達到了主要終點和所有四個次要終點,以及來自Chiasma MYCAPSSA的所有3期臨床試驗的所有安全數(shù)據(jù)��。MYCAPSSA處方信息中描述了以下重要的不良反應(yīng):膽石癥和膽石癥的并發(fā)癥�����;高血糖和低血糖��;甲狀腺功能異常�����;心功能異常����;以及維生素B12含量降低和希林(Schilling)測試異常。